Antennal Lobe
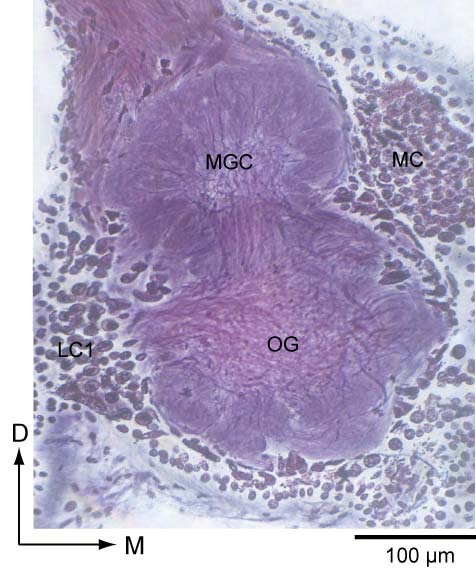
カイコガの触角葉.
1. はじめに
カイコガを用いた研究おいては,初めて性フェロモンの化学構造が同定され(Butenandt et al., 1959),またフェロモン受容体の配列が初めて特定されるなど(Sakurai et al., 2004),フェロモンを主とした匂いの処理の研究に重要な貢献を果たしてきた.また,その嗅覚受容から行動発現の経路がよく分析され,生体と機械を融合する学際分野発展の契機となった(Kanzaki et al., 2008).カイコガは神経科学に限らずこれまでに広く遺伝学の研究などに用いられてきた日本初のモデル生物である.また,ショウジョウバエ,カに続き,3種目にゲノムプロジェクトが終了しており(Xia et al., 2004; Mita et al., 2004; International Silkworm Genome Consortium, 2008),神経系における感覚情報処理を探るうえで有用なモデルシステムである.ここではカイコの嗅覚系の構造と機能について,特に中枢における情報処理に着目して解説し,カイコガを用いる嗅覚研究の今後の方向性を示すことを目的とした.以下特に記述しない場合はカイコガにおける知見を記述する.
2. 触角葉
2-1. 触角葉の神経回路.触角葉は,中大脳の密集型ニューロパイル構造であり,触角の神経細胞からの軸索が終末する領域である.触角葉は,領域内でのみ分枝を持つ局所介在神経,触角葉と上位中枢を結ぶ投射神経および嗅受容細胞の軸索からなり,相互に複雑なシナプスを形成する.シナプスが形成される領域は糸球体と呼ばれ,それらが多数集まりブドウの房状の構造を作っている.また上位中枢から触角葉にフィードバックする少数の遠心性神経が存在する.各神経の数は,昆虫の種により異なるものの嗅覚受容細胞が1万から10万,局所介在神経が300から750,投射神経が200から1000程度である.各神経の数から考えると,嗅覚受容細胞の情報は,触角葉で約1/100に収斂することになる.また,同じ嗅覚受容体が発現した嗅覚受容細胞は,特定の1個または2個の糸球体に投射している(Vosshall et al., 2000).触角葉のこのような構造は,脊椎動物の第一次嗅覚中枢である嗅球と類似しているが(Hildebrand & Shepherd, 1997),昆虫の糸球体の数はマウス(約1800)などと比較して桁違いに少なく(キイロショウジョウバエ,43; ミツバチ,166; カイコガ,60),個体間で同定することができることから(Anton & Homberg, 1999),昆虫の触角葉は,嗅覚情報処理システムを研究するうえでのよいモデルとなっている.また,ガ類の触角葉では顕著な性的二形がみられ,雄にはフェロモン情報処理に特化した大糸球体または大糸球体複合体とよばれる,ひときわ大型の糸球体がある.これに対し,一般臭の情報を処理する比較的小型の糸球体は常糸球体とよばれる.
2-2. 触角葉の構造.触角葉は中心部に繊維の集合体(Central fiber core)があり,周辺部にシナプス部位である糸球体が配置される.触角葉を構成する神経細胞の細胞体は,通常集合してクラスタを形成する.カイコガでは,主に3つの領域に集合し,それぞれメディアルセルクラスタ(Medial cell cluster, MC),アンテリアセルクラスタ(Anterior cell cluster, AC),ラテラルセルクラスタ(Lateral cell cluster, LC)と呼ばれる. LCはさらに前方のLCIと,後方のLCIIに分類される.クラスタを構成する神経細胞は異なる性質を持ち,投射神経の細胞体は,MC,AC,LCI,局所介在神経の細胞体は,LCI,LCIIの細胞体クラスタに属する.
2-3. 触角葉を分析するための方法論.カイコガの触角葉は,単一細胞レベルの電気生理学・形態学的手法(e.g. Kanzaki et al., 2003),神経集団の応答を計測する膜電位イメージングおよびカルシウムイメージング法(e.g. Ai et al., 1998, 2004; Fujiwara et al., 2009),免疫組織化学的手法(Iwano et al., 2005),遺伝学的な手法を用いた分析(Tanoue et al., 2001),分散培養系を用いる手法(Park et al., 2003; Kim et al., 2005),MEMSプローブを用いた光学的な測定手法(Shuzo et al., 2007),計算機シミューレション等(Yamasaki et al., 2006),様々な方法論によって分析されている.
3. 嗅受容細胞
触角上の感覚子は形状によって分類される.毛状感覚子 (sensilla trichoidea)は,後述のように雌雄で異なる特性を持つ.一方鐘状感覚子(sensilla coeloconia),錐状感覚子(sensilla basiconica)においては,植物臭に応答し,これまでに顕著な雌雄差は発見されていない(Pophof, 1997).感覚子の内部には嗅受容細胞や支持細胞などが配置されている.嗅受容細胞は,樹状突起を感覚子の先端の方へ伸ばし,匂いを受容する.入力量に依存して活動電位を発生して,中枢へ信号を送る.
3-1. オス特異的な嗅受容細胞.オス触角の毛状感覚子中の,2つの嗅受容細胞はそれぞれフェロモン主成分であるボンビコールとボンビカールに対する高い選択性を持ち(Kaissling et al., 1978),アフリカツメガエル卵母細胞を用いた遺伝子導入系とウイルスによる遺伝子導入を行ったメスカイコガの触角電図を測定することにより,BmOR1とBmOR3がそれぞれボンビコール,ボンビカールの受容体であることが分かった(Sakurai et al., 2004; Nakagawa et al., 2005).加えて,フェロモンの受容や,感度の調節に関わる様々な機構が分析されている(フェロモンの受容プロセスに関するモデル化(Minor & Kaissling, 2003),頻回刺激に対する応答(Barrozo & Kaissling, 2002),神経修飾物質による感度調節(Pophof, 2002) ,受容過程(Redkozubov, 2000)).
3-2. メス特異的な嗅受容細胞.メスの毛状感覚子内の一方の嗅受容細胞は,benzoic acidに,もう一方はlinaoolおよび2,6-dimethyl-5-hepten-2-olに選択性を示す(Heinbockel & Kaissling, 1996).カイコガの嗅覚受容体の解析が進み(Wanner et al., 2007),またヨトウガ由来の培養細胞に嗅覚受容体を発現させる実験系により,メスに特異的ないしは,メスにより多く発現するBmOR19,BmOR45およびBmOR47が重要であるらしいことが分かってきた(Anderson et al., 2009).BmOR19はlinaoolに,BmOR45, BmOR47はbenzoic acidに高い選択性を示す.これらの生理学的意義は不明であるが,Linaloolがクワ葉の匂い成分であることから,産卵行動に関わるとする説と,まだ存在が確認されていないオス由来のフェロモンであるとする説がある.Linaloolに対し,メスがはばたき行動を示すことが報告されている(Priesner, 1979).また,シスジャスモンに対する応答は試されていない.また,benzoid acidはカイコガの排せつ物に含まれる匂い成分であり,行動は引き起こさないものの,benzoic acid の選択性を持つ細胞を興奮させることが分かっている(Heinbockel & Kaissling, 1990).
4. 糸球体構造
触角葉の糸球体群は,大型の区画から構成される大糸球体と,比較的小型の糸球体群から構成される常糸球体に大別される(図1).大糸球体は触角神経から近い部位に配置され,触角神経から遠位には,常糸球体が配置される.この構成はゴキブリ・ミツバチ・チョウなどとも共通している.またショウジョウバエでは大糸球体のような顕著な構造はないものの,フェロモン情報処理を担う糸球体であるDA1,VA1l,VA1mがやはり触角神経の触角葉への入力部位に近接して存在している(Laissue et al., 1999).
4-1. 大糸球体.カイコガの大糸球体は,触角神経の入力部位から順に,その形状に基づきキュムラス,トロイド,ホースシューと命名されている.大糸球体構造はガ,ゴキブリ等で観察され,近縁種同士では非常によく似た構造を持つ.例えばタバコスズメガでは,大糸球体のうち最も背側の区画(キュムラス)がフェロモン主成分のボンビカールへの選択性を持つが,カイコガにおいても同様にキュムラスがフェロモン副成分となっているボンビカールへ高い選択性を持つ(Vickers et al., 1998; Kanzaki et al., 2003).
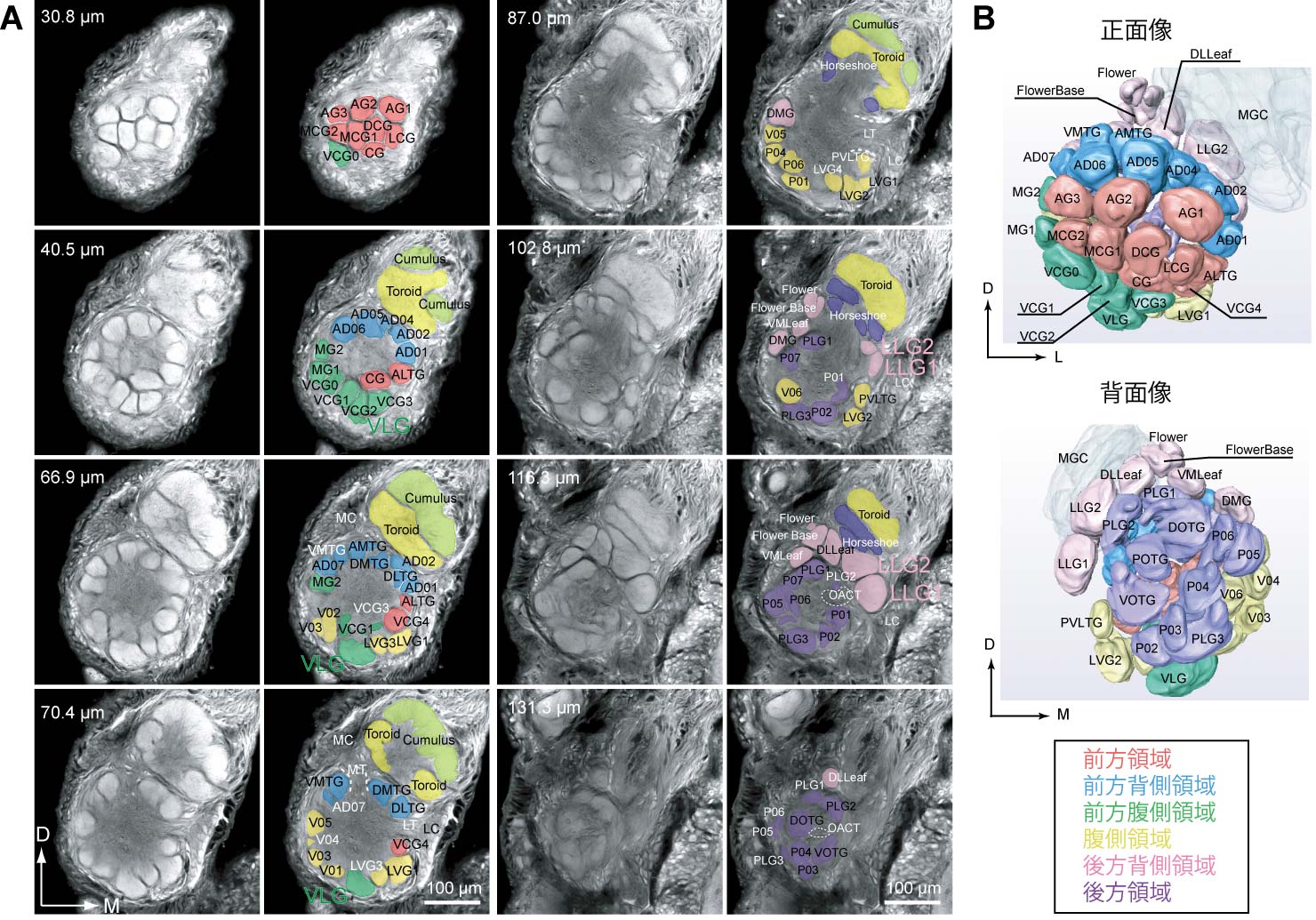
4-2. 常糸球体.カイコガの常糸球体に関しては,渡銀染色法を用い,大糸球体と隣接する背側内側部の小型の糸球体群(Koontz & Schneider, 1987; Medial small glomeruliとして記述),またLabial pit organより投射を受ける糸球体 (Kent et al., 1986; LPOGとして記述) があるものの,体系だった報告はなかった.われわれは,共焦点顕微鏡で観察した画像をラベルすることによって,糸球体の三次元画像データを取得し,異なる個体の間によって糸球体の同定手法を検討した(Kazawa et al., 2009).触角葉における特徴的な神経路およびサイズの大きな3つの糸球体(LLG1,LLG2,VLG)を基準とし,前方(A),前方背側(AD),前方腹側(AV),腹部(V),後方背側(PD),後方(P)の6領域に分割し,それぞれの領域の内部においてさらに同定を行う手順を取った(図1).6領域への分割は形態学的な情報にのみ基づいており,機能と必ずしも対応しない.この結果,カイコガの常糸球体は約58-62個の糸球体から構成され,その39個について完全な同定法を,また,その他の糸球体についてもどの領域に所属するかを完全に決めることができるようになった.糸球体のサイズ・形状には領域ごとの特徴があり,例えば表面の糸球体については球形に近いものが多く,後方の糸球体では,形状が歪み,また境界が不明瞭な場合が多かった.同様の傾向は,ショウジョウバエやカにおいても報告されている(Laissue et al., 1999; Ignell et al., 2005).
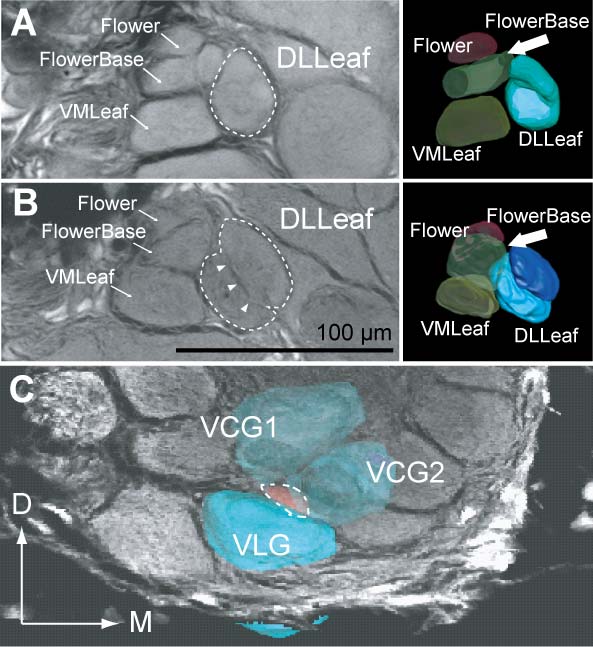
4-3. 糸球体構造の多型.これまでの糸球体構造の三次元再構築による研究と比較し,われわれは10個の個体に基づいて分析を行ったところ,従来個体間で高い再現性があるとされてきた糸球体構造の中には,個体による差異が生じていることが分かった.これらの差異のうち,あるものは同じタイプの差異が,同じ領域で観察される場合があり,こうした再現性のある変化を糸球体構造の多型と呼ぶことにする.こうした再現性のある,糸球体構造の変化は,ハチでも報告されている(Smid et al., 2003).多型の種類は大きく2つあり,第一に特定の同定糸球体,DLLeaf(背側後方領域に所属)が分割することである(図2A,B).通常のケースにおいて単一のDLLeafが個体によっては,前方の比較的小型の糸球体と,後方の中型の糸球体に分割する.次に,前方腹側,腹側領域など,表面に近い糸球体群の間に体積の小さな糸球体が出現することである(図2C).こうした変異の体系だった報告は初めてであるが,後者の変異については,ショウジョウバエで類似の報告があり,やはり表面に近い領域でこうした小糸球体の出現が起こるケースがあるようである(Laissue e al., 1999, satellite glomerulusとして記述).また他種のガにおいても最もサイズの小さい糸球体の有無という多型が報告されている(Berg et al., 2002).
4-4. 性的二型.ガ類においては,触角葉における性的二型が顕著である.オスで存在する性フェロモン処理を担う大糸球体の代わりに,メスに特異的な糸球体が存在する.タバコスズメガ等においては3つのメス特異的な糸球体が出来(Rospars & Hildebrand, 1992),うち比較的大型で外側に位置する糸球体が(+)-linaloolに高い選択性を示すことが分かっている(lateral large female glomeruli; Reisenman et al., 2004).カイコガにおいては,メスの触角葉では,大糸球体が欠落し,代わりにLLG1,LLG2が拡大する(図.;Koontz & Schneider, 1987).LLG1,LLG2はメス毛状感覚子の嗅受容細胞の投射を受け,benzoic acidやlinaloolなどの処理を担うと考えられる.オス触角葉において,LLG1から入力を受ける投射神経は,青葉アルコール,リナロール,シトラールに応答し(Namiki & Kanzaki, 2008),植物の匂いの情報処理に関与することが示唆されるが,更なる試験が必要である.メスの産卵行動との関連を考慮すると,BmOR59を介して受容される,クワ葉の匂い成分で幼虫への誘因効果を持つ匂い物質である,シスジャスモンに対するLLG1,LLG2の応答性は興味深い(Tanaka et al., 2009; 山岡,1999).
5. 局所介在神経
5-1.形態学的特徴.局所介在神経は,触角葉の内部にのみ神経突起をもち,触角葉の情報処理を担う,主要な細胞である.タバコスズメガおいては分析例があるものの,共焦点顕微鏡を用いた体系的な分類はカイコガで初めて行われた.全ての糸球体に一様な分枝を持つGABA免疫陽性細胞が最も多いことが分かった.最も主要なタイプでは,糸球体の芯部に分枝を持つものが多かった(図3A).またこのほかにも分枝する糸球体数・形状・免疫反応性にも様々な多様性があることが明らかになった(Seki & Kanzaki, 2008).2つ目のタイプは全域に分枝を持つが,分枝が糸球体の芯部・表層部を含む全域に至るものであった.これら以外にも,大糸球体への分枝の有無,常糸球体の前方内側部への分枝の有無などによって分類が可能であった.
5-2.匂い応答特性.こうした局所介在神経の匂い応答を測定すると,フェロモンや,植物臭全般に対し,広い匂い応答性を示し(図3B),また機械感覚への応答を示すことも明らかとなった(並木,関,神崎,未発表).基本的には興奮性の応答を示し,フェロモン主成分のボンビコールに対しては抑制応答を示すケースがあった.また,全体として,同一の濃度であれば,ボンビコールより,ボンビカールに対してより強い応答を示した.タバコスズメガにおいて詳細な電気生理学的・薬理学的な知見が存在するが,遺伝学的な手法が適用可能なカイコガにおいて更なる調査が期待される.また局所介在神経のフェロモン応答特性が,カルシウムイメージング法によって調べられている(Fujiwara et al., 2009).
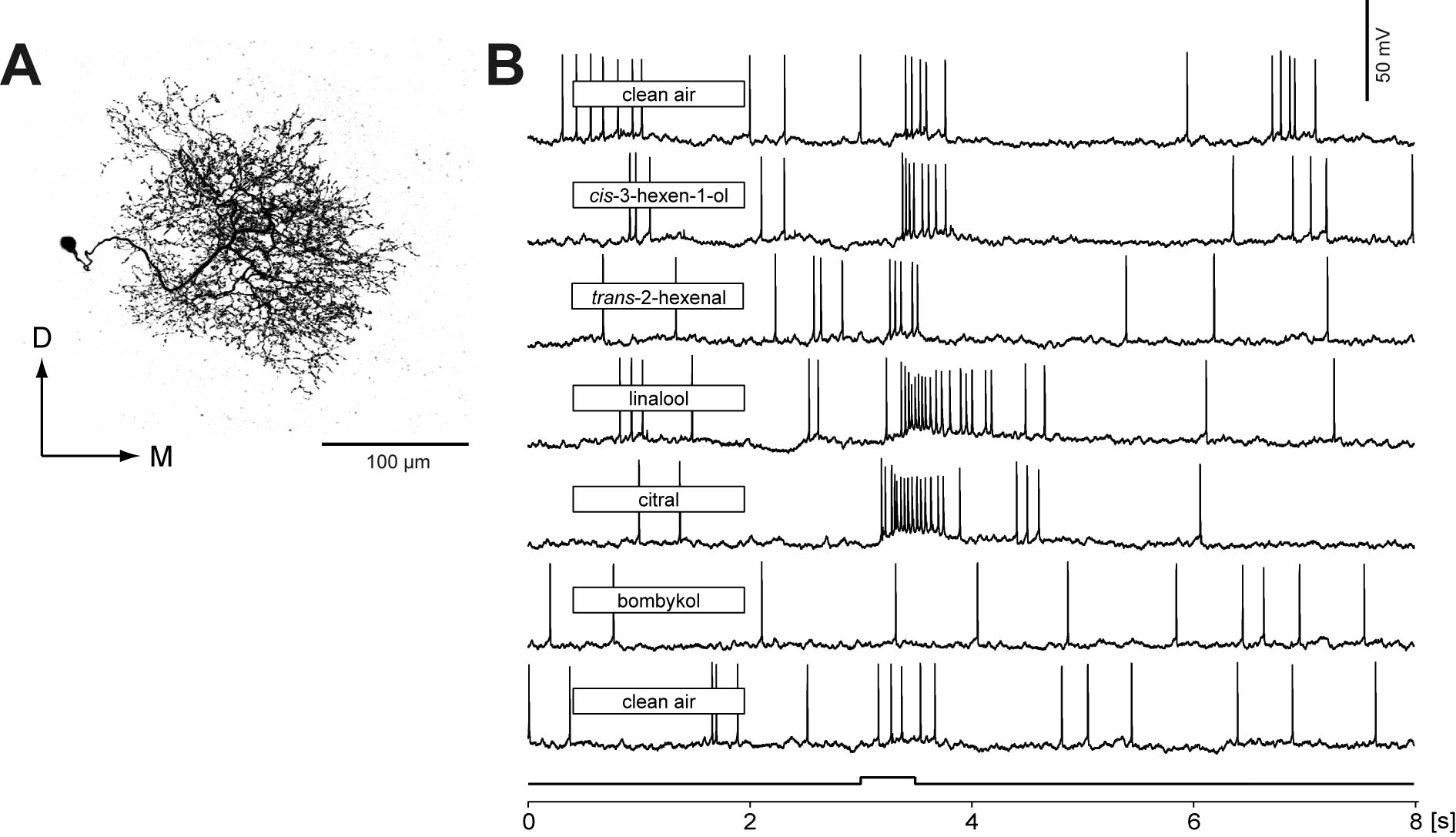
図3.触角葉局所介在神経.A.タイプI局所介在神経の共焦点顕微鏡像.B.局所介在神経の500 ms刺激に対する応答.
6. 投射神経
6-1.一般的な形態学的特徴.投射神経は一つまたは複数の糸球体から入力を受け,触角脳経路(Antenno-cerebral tract)と呼ばれる神経束を通り,前大脳キノコ体あるいは前大脳側部へ軸索投射を持つ.
6-2. 大糸球体投射神経.大糸球体から入力を受ける投射神経は,フェロモンに対して高い感度で応答する(Kanzaki & Shibuya, 1983, 1986).共焦点顕微鏡を用いた,投射神経の単一細胞標識と,糸球体構造の観察によって,大糸球体の内部での機能構造が明らかとなった(Kanzaki et al., 2003).即ち,大糸球体の特定の区画キュムラスはカイコガ性フェロモン副成分のボンビカールに対して高い選択性を示し,さらに腹側の区画トロイドは性フェロモン主成分のボンビコールに対して高い選択性を示す.触角葉の出力のレベルにおいても高い選択性が維持されており,脳内でのラベルドラインの存在が示された.さらに別の区画であるホースシューはボンビカールに対し,応答を示した. キュムラス投射神経の樹状突起は,糸球体のほぼ全域にわたって分枝するが(図4G-I),トロイド投射神経の樹状突起は,糸球体の内側・外側両方に分枝する例と(図4A-C),外側のみに分枝する例が観察された(図4D-F).これは,嗅受容細胞の軸索投射のトポロジーとよく対応している.即ち,触角中のMeidal Nerveを通る神経はトロイドの全域に,また,Lateral Nerveを通る神経は主としてトロイドの外側の領域に投射する(Ai & Kanzaki, 2004).こうした触角上の空間情報が2次の神経細胞にまで維持され,上位中枢に伝達されていることを示唆する結果である.
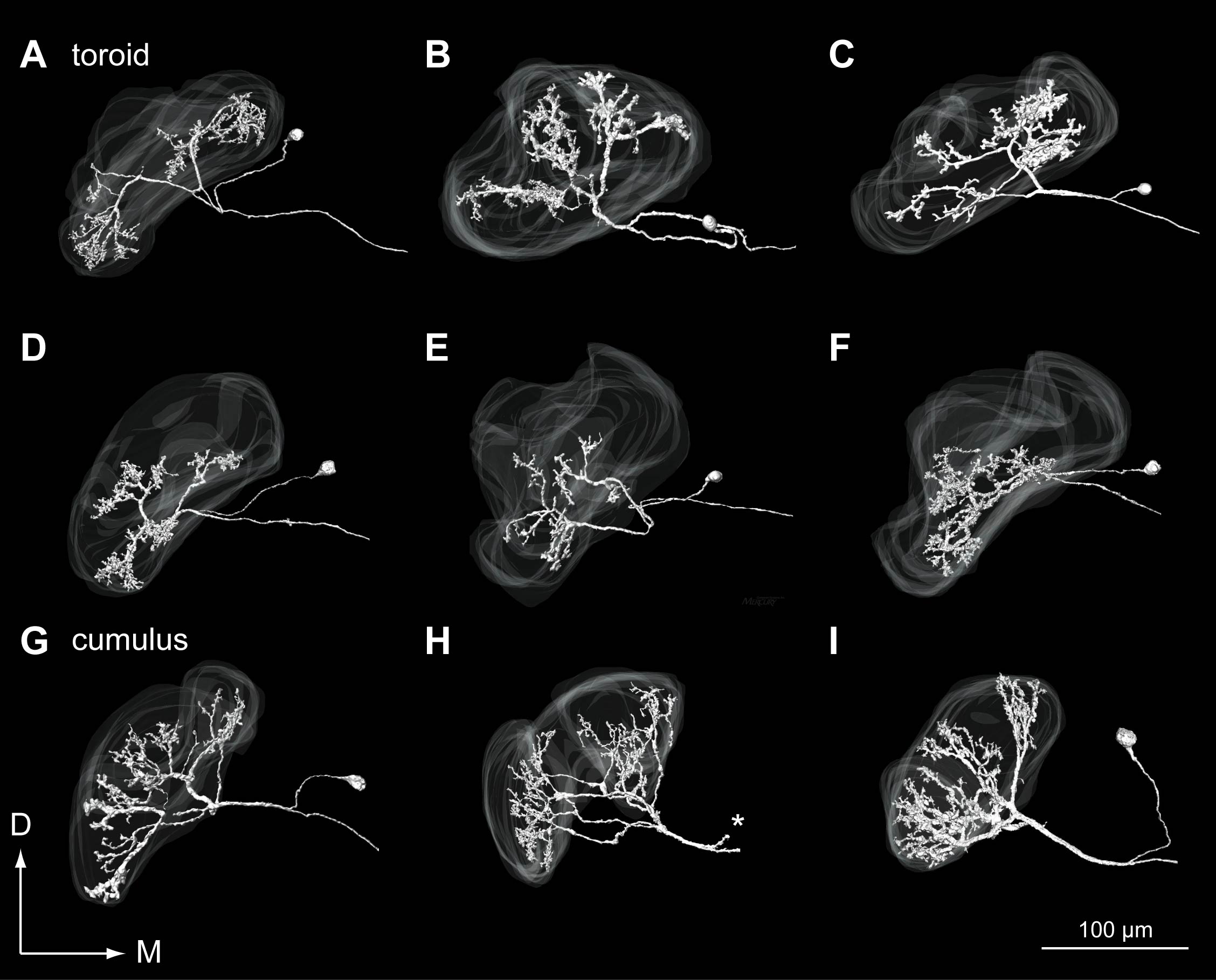
図4.大糸球体投射神経.A-F.トロイドから入力を受ける投射神経.内側・外側の両方に分枝をもつもの(A-C)と,主として外側のみに分枝をもつ細胞(D-F)がある.G-I.キュムラスから入力を受ける投射神経.(Namiki et al., 2010より改変)
6-3. 常糸球体投射神経.糸球体の同定法の確立後,われわれは常糸球体から入力を受ける投射神経の細胞内記録法および染色法による分析を行った(図5).大糸球体の投射神経が糸球体外の分枝を持たなかったのに対し,常糸球体のほとんどの投射神経は糸球体外に粒状の分枝を持っていた.また,こうした糸球体外の分枝は,同じ同定糸球体であってもそのパターンはわずかに異なっていることが分かった.単一の糸球体には複数の投射神経が分枝することから,この糸球体外の分枝パターンが全く再現性のないものか,同一個体の細胞間で保存されているのかどうかは不明である.また,これらの投射神経の応答パターンを分析し,比較することなどによる,こうした多型の生理学的意義を解明することが今後の課題である. 常糸球体投射神経は主として植物臭に対して広い応答性を示し(図6),フェロモンに対しては,応答しないか弱い抑制を受ける(並木と神崎,未発表).また発火率の時間変動は,大糸球体の投射神経に比べて多様なパターンがあった.また単一の化合物に対してもほぼすべての投射神経が応答性を示し,中枢においては匂い情報が分散して表現されていることが分かる.
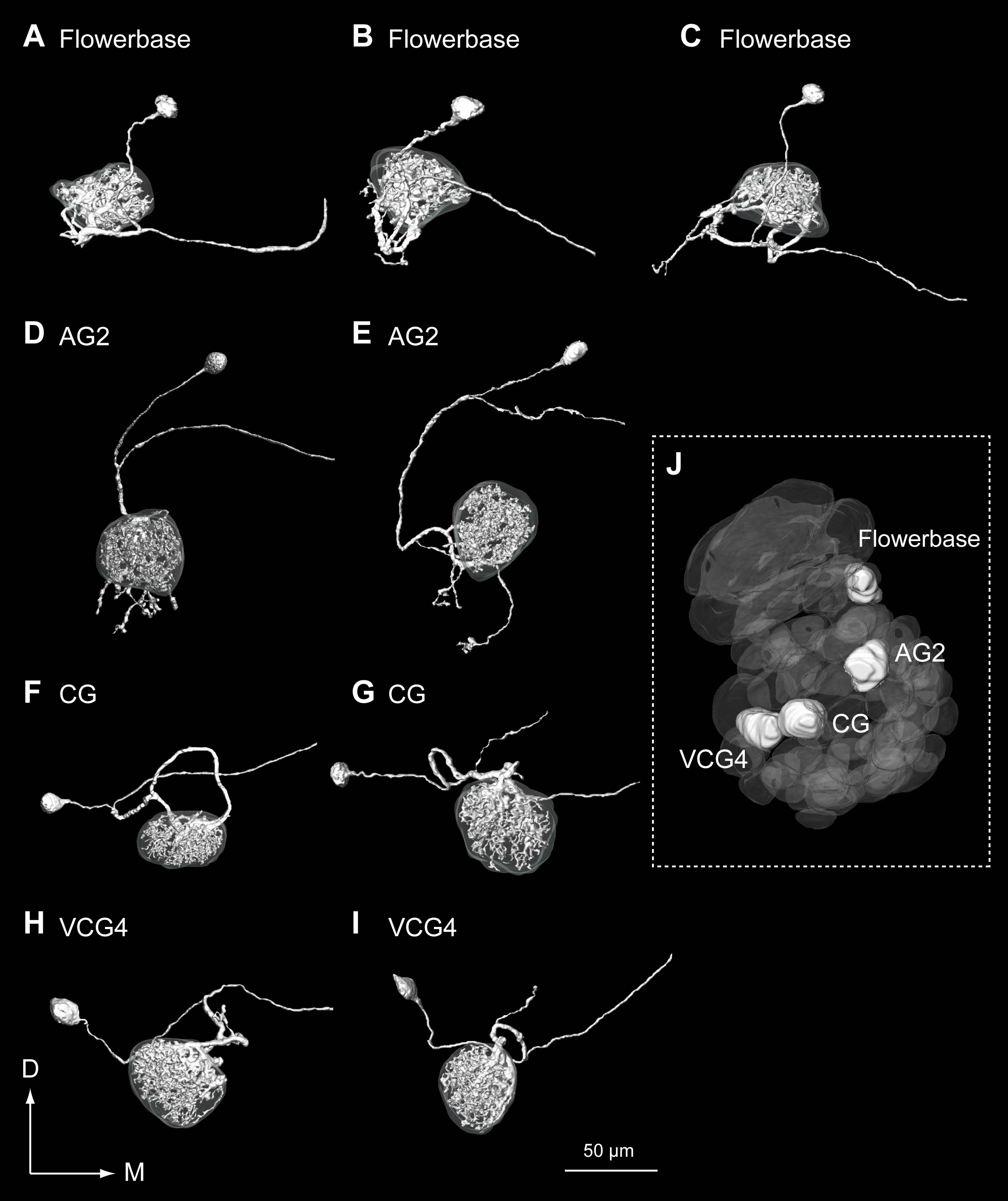
図5.常糸球体投射神経の形態.Flowerbase(A-C),AG2 (D,E),CG(F,G),VCG4(H,I)に樹状突起を分枝する投射神経.J.上記4糸球体の空間位置.(Namiki et al., 2010より改変)
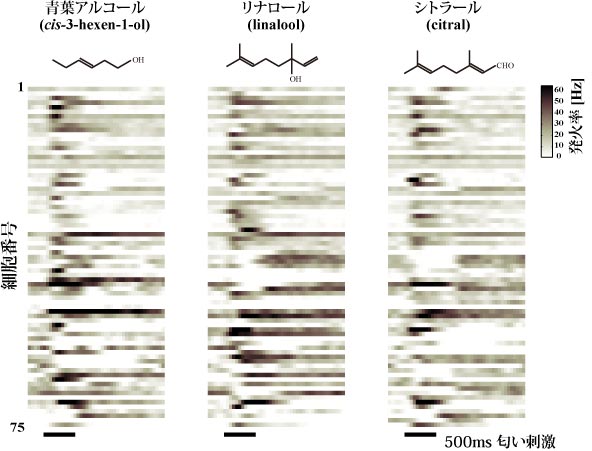
図6.触角葉投射神経の植物臭に対する応答.75個の常糸球体投射神経の3種類の匂いに対する応答を疑似カラーで示す.
6-4. 上位中枢への軸索投射.投射神経の出力に関して,ガ類ではタバコスズメガにおいて,体系だった分析がなされている.カイコガにおいても同様に,内側触角脳経路(inner antenno-cerebral tract; IACT),中側触角脳経路(middle antenno-cerebral tract; MACT),内側触角脳経路(outer antenno-cerebral tract; OACT)に加え,少数ではあるものの,背側触角脳経路(dorsal antenno-cerebral tract; DACT)および背側内側触角脳経路(dorso-medial antenno-cerebral tract; DMACT)を通る経路も発見された(図7).IACTを通る投射神経の軸索投射は前大脳のキノコ体傘部を通り,前大脳側部へ出力する.OACT,MACTを通る投射神経は,まず前大脳側部に投射し,割合は少ないものの,キノコ体傘部にも投射する. cAMP合成酵素による免疫組織化学染色から,トロイドから入力を受ける神経群を選択的に標識できることがわかり,単一細胞染色を組み合わせて分析を行ったところ,トロイドの投射神経は前大脳側部よりもやや前方内側の三角形の領域(ΔILPC)に終末し,常糸球体の終末領域である前大脳側部からは分離されていることが分かった(Seki et al., 2005).また,常糸球体の中でも投射領域の違いが観察された(Namiki & Kanzaki, 2010).OACTを通る投射神経の多くは,触角葉内の後方領域に所属する糸球体から入力を受けることから,前述の知見と合わせ,触角葉から前大脳への機能地図の変換は,大糸球体・後方領域を除く常糸球体群,後方領域の常糸球体の3部位の分離がそのまま維持されていることになる.
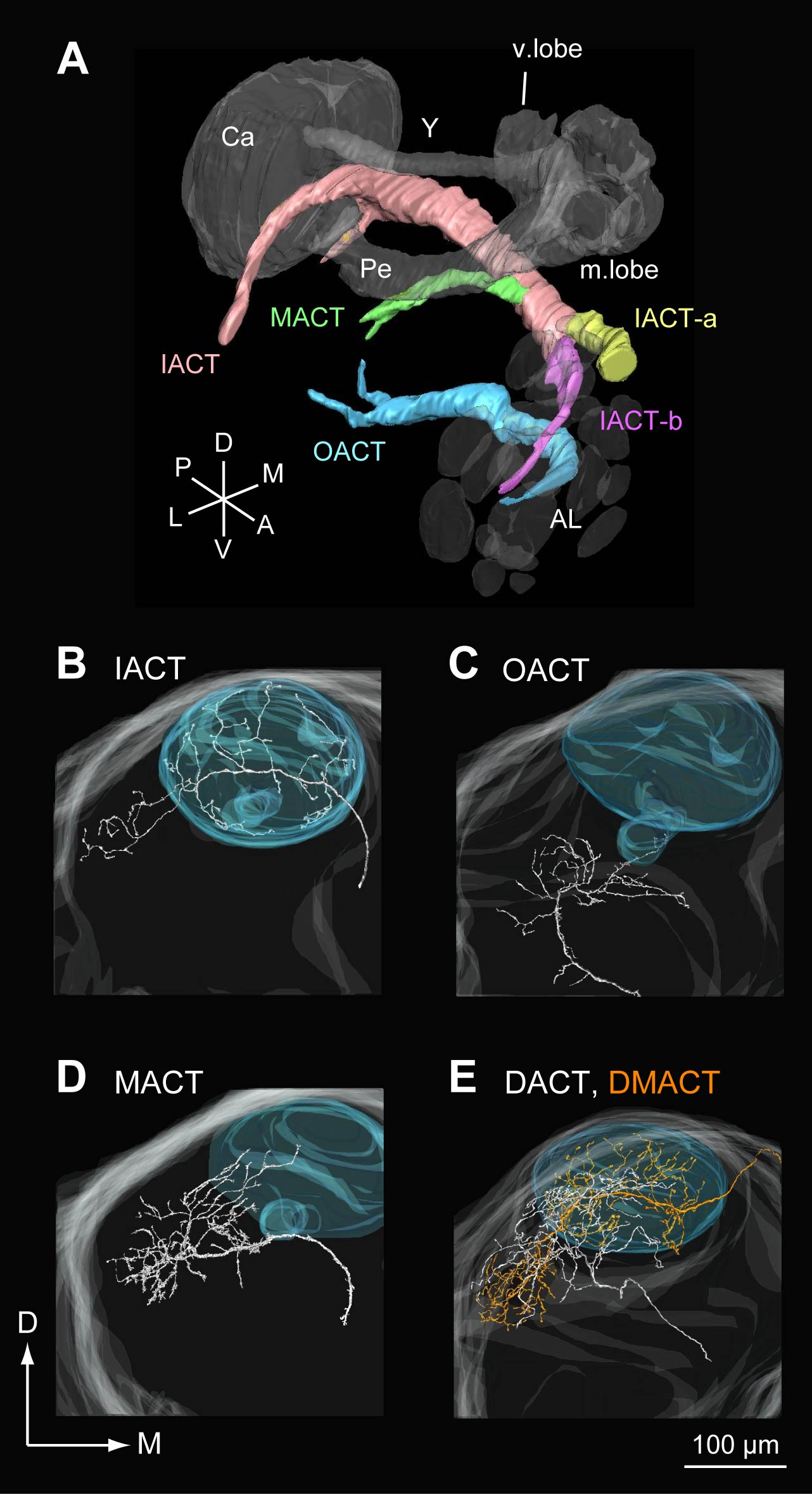
図7.投射神経の軸索投射.A.カイコガの3つの主要な触角脳経路.IACT(C),OACT(B),MACT(D),DACTおよびDMACT(E)を通る投射神経の軸索投射.水色でキノコ体傘部および柄部の概形を表す.(Namiki et al., 2010より改変)
6-5. 糸球体構造の変化に対応した投射神経の形態変化.糸球体の同定法の確立後,われわれは常糸球体から入力を受ける投射神経の細胞内記録法による分析を行った.4-3.で記述したように,触角葉の糸球体構造には多型がある.われわれはこれらの同定糸球体DLLeafの分割,小糸球体の出現に対応する投射神経の形態変化を発見した(図8).DLLeafが分割していない触角葉において,DLLeafを染色したところ,投射神経は糸球体内全域に分枝を持っているが,DLLeafが分割した例においては,前方のみ,後方のみに分割する例が観察された.また,多型に相当する糸球体のうち,最大径25 µm以下の小糸球体に分枝を持つ投射神経は,複数糸球体に分枝するタイプのみであった.このことから,新たに小糸球体が出現した場合には,ここから入力を受ける投射神経が用意されるのではなく,元々存在する投射神経が,出現した小糸球体にも樹状突起を伸ばすことが推測される.
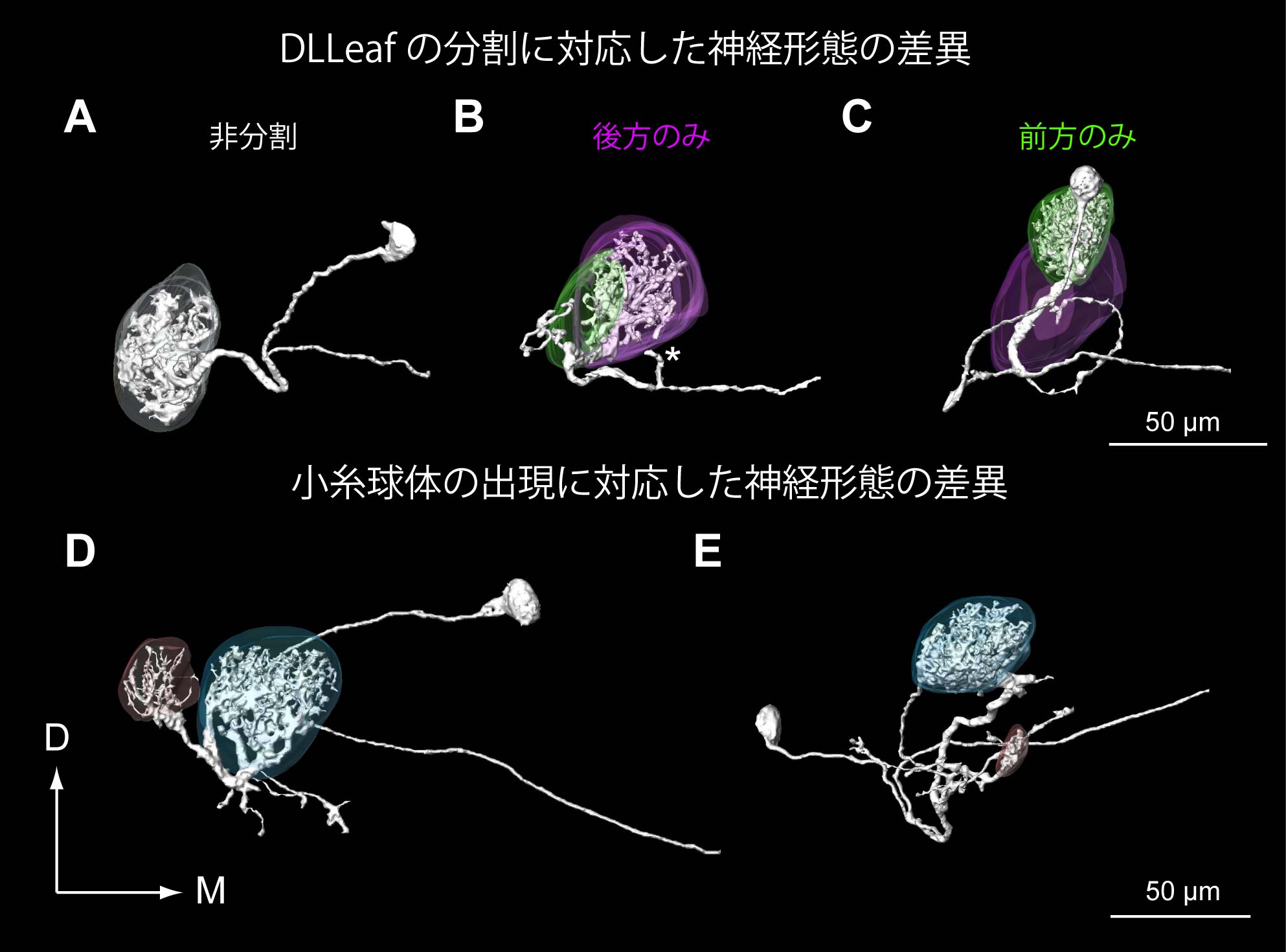
図8.糸球体構造の多型に対応した投射神経形態の差異.A.非分割型DLLeafに分枝する投射神経.B.分割型DLLeafの後方部に分枝する投射神経.C.分割型DLLeafの前方部に分枝する投射神経.D,E.2糸球体に分枝する投射神経.いずれも小型の糸球体(赤)へ分枝する.(Namiki et al., 2010より改変)
7. 神経回路レベルの応答分析
一般臭の,触角葉における匂いの符号化は,複数の糸球体に分散して表現されるが,情報符号化機構については議論がある(Laurent, 2002; Christensen et al., 2003; Ito et al., 2008).こうしたバッタなどで提唱されてきた,持続する振動の各サイクルにおける活動情報によって,情報が符号化されているという仮説と,タバコスズメガにおいて提案されている,同期性を用いず,各細胞の発火活動の時間的・空間的な組み合わせによって符号化されているという仮説がある(Christensen et al., 2000; Ensemble coding).
7-1. 膜電位イメージング法.膜電位イメージング法は,ニューロンの膜電位に比例して蛍光強度が変化する色素を用いて神経組織を染色し,神経細胞の膜電位変化を光によって観察する手法である.岡田らは,in vivo 標本における触角葉の膜電位イメージングを成功させ,糸球体特異的に匂い応答の周波数特性が異なることなどを発見している(Okada et al., 1996, 2001).同手法はカイコガにも適用され(Ai et al., 1998; Hill et al., 2003; Ai & Kanzaki, 2004; 藍と神崎,2004),
7-2. カルシウムイメージング法.膜電位イメージング法による匂い応答の計測は一般にS/Nが小さく,時間分解能は低下する物の,高S/Nでの計測が可能となるカルシウムイメージングによる匂い応答の計測は,ミツバチなどで最初に行われ(Joerges et al., 1997),他の昆虫にも用いられている.カイコガにおいてもAM体で触角葉の神経集団の活動の空間パターンの計測に成功している(Okada & Kanzaki, 2004),また最近電気穿孔法によって,カルシウム指示薬を導入し,単一細胞レベルの解像度を維持し,複数の神経細胞の活動を測定することも可能となってきている(Fujiwara et al., 2009).
7-3. 仮想触角葉の再構成による時空間応答の分析.前述のように,細胞内記録法では時間分解能はよいが,空間分解能に難がある.イメージング法では,空間分解能はよいものの,時間分解能の取得に難がある.タバコスズメガ等で行われている多点同時細胞外ユニット計測の手法では(Christensen et al., 2000),多細胞の高精度の時間応答は得られるが,計測点の同定に難がある.こうした課題を克服すべく,われわれは,細胞内記録法と,個体間で保存された糸球体構造のアトラスを組み合わせることで,時空間応答を分析する構成的アプローチを提案した(Namiki & Kanzaki, 2008).すなわち,単一細胞のレベルでは高時間分解能で計測が可能な神経活動を集積した後,設計図(糸球体構造のアトラス)を元に空間情報を付加して,時空間応答を再構成する手法である. 実際にカイコガにおいて,異なる個体で,同一の糸球体に入力を受ける投射神経の匂い応答特性を計測したところ,振幅に変動があるものの,基本的に類似しており,20Hz程度であれば,個体間で応答を比較することができることが分かった.カイコガ投射神経の主要タイプである,単一糸球体タイプの神経の発火頻度に基づき,この応答を計測することで,触角葉からの出力を糸球体単位でモニタできることになる.発火頻度情報を糸球体構造のアトラス上に再現し,触角葉全体としての活動を再構築した(図9).この時空間応答のパターンを分析することにより,応答の開始から,150-200 ms程度で最も匂いの識別能力が高いこと,匂いの提示が終了した際の応答(オフセット応答)は,匂いのオンセット応答とは異なるパターンであるが,匂いの識別情報を符号化しうること,さらにその後も数秒間,匂い識別に充分な情報が残存することが分かった. 以上は,信号源(糸球体)を特定した上で,発火率(電気的信号)に基づくデータを,初めて提示したことに加え,タバコスズメガにおいて提唱された匂いのEnsemble codeの具体例を初めて提示したと考えている.
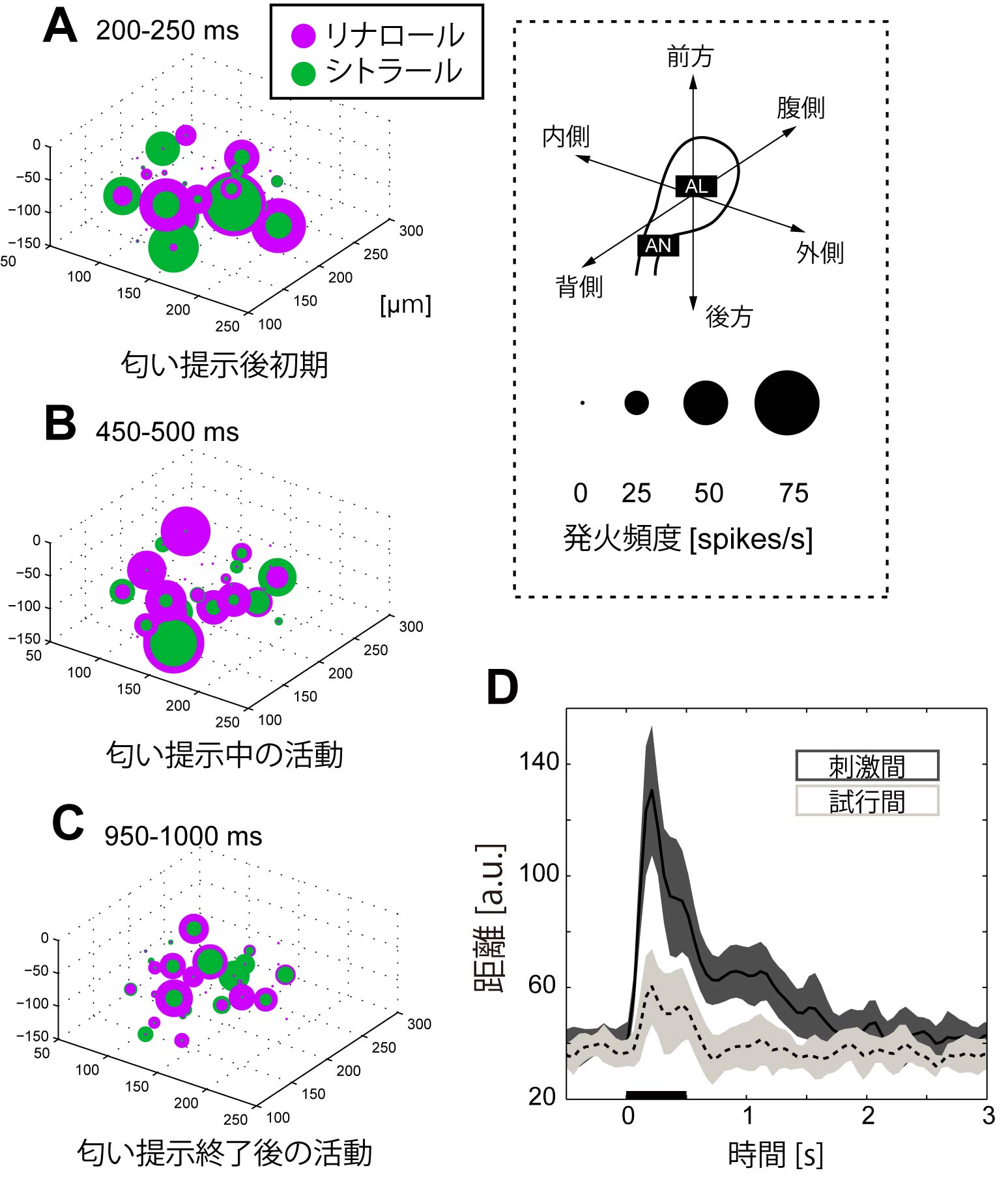
図9.匂いによって起こる時空間応答.A-C.32個の投射神経の匂いによる発火頻度変化.500ms間匂い刺激を提示した際の,各投射神経の発火頻度変化を,分枝する糸球体の重心を中心とした球の大きさとして示す.D.異なる匂い刺激間(黒)および同一刺激かつ異なる試行時の神経集団の発火頻度パターンの差異.縦軸は30個の投射神経の発火頻度を要素とするベクトル間のユークリッド距離.黒バー(500ms)の部位において匂いを提示した.
8. 神経伝達物質および神経修飾物質
触角葉における主要な興奮性神経伝達物質はアセチルコリン,主要な抑制性神経伝達物質はGABAである.また,グルタミン酸,セロトニン,オクトパミン,ドーパミン,その他の神経ペプチド等,種々の神経伝達物質,神経修飾物質が知られている(ガ:Berg et al., 2007).一部の神経修飾物質の機能については様々な手法により,明らかにされつつある.例えばセロトニンについては,生理機能がよく解析されている(総説:Kloppenburg & Mercer, 2008).日内リズムによって脳内のセロトニン量が変動し(Gatellier et al., 2004),またセロトニンによって神経細胞のフェロモンへの応答性が増強されることが分かっている(Kloppenburg et al., 1999). カイコガにおいては,セロトニン免疫陽性の神経細胞の性質がよく分析されている(Hill et al., 2002).この細胞は,左右で一対から数対存在することが知られている,ほとんどの昆虫で観察され,種間である程度保存された神経細胞であると考えられる(Dacks et al., 2006). 膜電位感受性色素を用いた高速イメージングを用いた実験により,カイコガにおいても同様にセロトニンが大糸球体と一部の常糸球体の応答性を増大させる作用を持つことが分かっている(Hill et al., 2003).セロトニンを投与すると,大糸球体の応答性が上昇し,ダイナミックレンジが変化する.また,常糸球体の腹側,外側部の領域(LVG2, LVG3, PVLTG等の糸球体に該当する可能性がある)の一部も電気刺激に対する応答性が上昇する.セロトニンによって,入出力特性が変化する糸球体とそうでない糸球体の機能的な差異は不明である.
9. 複合臭の処理
9-1. フェロモン臭の混合物情報の処理.ガ類においては,性フェロモンの混合比が種認識に重要である.カイコガにおいては,ボンビカールを混合するとフェロモン源探索行動の閾値が上昇する.ボンビカールの生理学的な意義は未だに分かっていない.オスカイコガは,プルーム状に離散的に分布するフェロモンを捉えることで,メスへの定位を実現している.ボンビカールの意義の一つの仮説として,オスがメスに接近し,ボンビコールがプルーム状ではなく,連続的に分布する状況になった場合に,ボンビカールが混合することで,適度な抑制が入り,定位を実現する機構が考えられる.他種のガにおいては,触角葉の投射神経のレベルで,フェロモンの主成分と副成分を混合することで,刺激追従性が向上することが知られており(Christensen & Hildebrand, 1997; Lei & Hansson, 1999),この説明を支持する.ボンビカールの機能については,野生のクワゴ(Bombyx mandarina)を用いた実験系で明らかになるであろう.
9-2. 一般臭の混合物情報の処理. カイコガの投射神経に対し,二種植物臭の混合物を与えた結果,①いずれかの単一成分と類似の応答,②二成分の線形和,③①,②のいずれでもないケースが観察された(図10A,B).①の例においては,特定の匂い混合物に対し,糸球体での処理において引き込みが起こっていると考えられる.混合物の成分の決定,あるいは三成分以上のケースにおける情報処理機構の解明が今後の課題であろう.
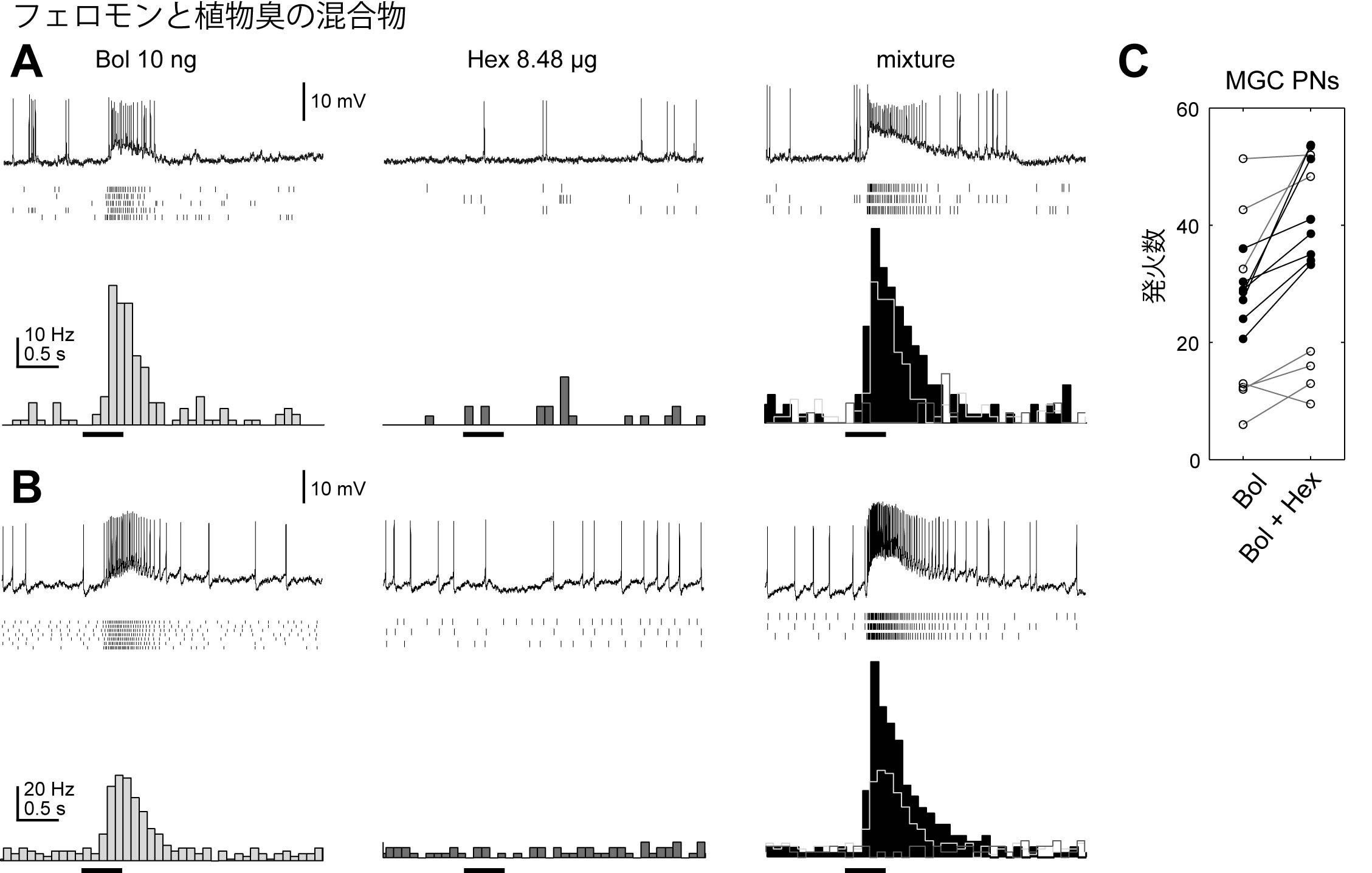
図10.常糸球体投射神経の複合臭に対する応答.A,B.植物臭同士の混合物に対する応答.上段が膜電位変化,中段は発火タイミングのラスタープロット,下段は平均発火率の時間変化を示す.Aでは,linaloolに興奮応答を示し(左),青葉アルコールでは抑制される(中)が,混合物に対しては,持続的な興奮応答を示す(右).C,D.植物臭とボンビコールの混合物に対する応答.青葉アルコール単体に対する応答(中)と,ボンビコールを添加した場合の応答(右)はほとんど変わらない.E.常糸球体投射神経の青葉アルコール応答における,他の匂いの影響.単体および混合物への応答の相関係数を取り,パターン変化の指標とした(Component Dominance).植物臭同士を混合するとパターンは変化するが,フェロモンを混合しても変化しない(p < 0.05, Wilcoxon rank sum test).(Namiki et al., 2008より改変)
9-3. フェロモンと一般臭の混合物情報の処理.野外において,フェロモンは植物由来の,他の匂い物質とともに存在し,こうした背景臭の存在下でフェロモンへの行動発現が調節されることが知られている.他種のガで,嗅受容細胞のレベルでlinalool存在下で性フェロモンに対する増強作用が報告されている(Ochieng et al., 2002).カイコガにおいても,植物臭が誘因増強作用がもつかどうか検討したところ,フェロモン主成分であるボンビコールに対し,寄主植物クワ葉の揮発成分である青葉アルコールを添加すると,行動の発現率が上昇することが分かった(Namiki et al., 2008).また,テルペン系のシトラールに対しては顕著な増強作用が見られないことから,植物臭いの中でもフェロモン情報処理におよぼす影響が一様でないと考えられる.続いてわれわれは,性フェロモンと植物臭の混合物に対する中枢の神経細胞の応答を世界で初めて計測した.通常はボンビコール単独で興奮作用を示すが,青葉アルコールを添加することによって,さらに活性が上昇する,という行動実験と対応した結果を得た(図11).反対に,青葉アルコールに応答する神経細胞については,フェロモンと同時に受容が起こった場合でも,応答性がほとんど変わらないことも分かった(図10C,D).これは,昆虫がフェロモンを同時に受容した場合でも,植物臭の匂い識別機構はあまり影響を受けないことを示唆する結果である. フェロモンに対する応答性の増強が起こる部位として,この時点で,①匂いの受容器レベル,②中枢神経系レベルの2つの候補部位が考えられた.ここで,フェロモンと植物臭を触角上の別々の部位に提示する行動実験を行ったところ,行動発現率が有意に低下したことから,フェロモンと匂いが触角上の同じ部位(おそらくは同一の細胞)に当たることが重要であり,①の受容器レベルの機序を支持する.

図11.青葉アルコールの付加で増強される大糸球体投射神経のフェロモン応答.A,B.トロイド投射神経の匂い応答.上段が膜電位変化,中段は発火タイミングのラスタープロット,下段は平均発火率の時間変化を示す.単体では,ボンビコールに興奮応答を示し(左),青葉アルコールには応答しない(中)が,混合物に対しては,ボンビコール単体より強い応答を示す(右).C.トロイド投射神経の匂い刺激0-1秒間の発火頻度.ボンビコール単体で与えた場合(Bol)に比べ,cis-3-hexen-1-olを添加した場合(Bol+Hex)で発火頻度の上昇が観察される(p < 0.001, Wilcoxon signed rank test).黒丸,白丸はそれぞれ10 ng,100 ngのボンビコールを用いた例.(Namiki et al., 2008より改変)
参考文献
Ai H, Kanzaki R (2004) Modular organization of the silkmoth antennal lobe macroglomerular complex revealed by voltage-sensitive dye imaging. J Exp Biol 207:633-644.
Ai H, Okada K, Hill ES, Kanzaki R (1998) Spatio-temporal activities n the antennal lobe analyzed by an optical recording method in the male silkworm moth Bombyx mori. Neurosci Lett 258:135-138.
Anderson AR, Wanner KW, Trowell SC, Warr CG, Jaquin-Joly E, Zagatti P, Robertson H, Nwecomb RD (2009) Molecular basis of female-specific odorant response in Bombyx mori. Insect Biochem Mol Biol 39:189-197.
Barrozo RB, Kaissling KE (2002) Repetitive stimulation of olfactory receptor cells in female silkmoths Bombyx mori L. J Insect Physiol 48:825-834.
de Brito Sanchez MG, Kaissling KE (2005) Inhibitory and excitatory effects of iodobenzene on the antennal benzoic acid receptor cells of the female silk moth Bombyx mori L. Chem Senses 30:435-442.
Gatellier L, Nagao T and Kanzaki R (2004) Serotonin modifies the sensitivity of the male silkmoth to pheromone. J Exp Biol 207: 2487-2496.
Fujiwara T, Kazawa T, Haupt SS, Kanzaki R (2009) Ca2+ imaging of identifiable neurons labeled by electroporation in insect brains. NeuroReport 20:1061-1065.
Fukushima R, Kanzaki R (2009) Modular subdivision of mushroom bodies by Kenyon cells in the silkmoth. J Comp Neurol 513:315-330.
Heinbockel T, Kaissling KE (1996) Variability of olfactory receptor neuron responses of female silkworms (Bombyx mori L.) to benzoic acid and (±)-linalool. J Insect Physiol 42:565-578.
Hill ES, Iwano M, Gatellier L, Kanzaki R (2002) Morphology and physiology of the serotonin-immunoreactive putative antennal lobe feedback neuron in the male silkmoth Bombyx mori. Chem Senses 27:475-483.
Hill ES, Okada K, Kanzaki R (2003) Visualization of modulatory effects of serotonin in the silkmoth antennal lobe. J Exp Biol 206:345-352.
Homberg U, Christensen TA, Hildebrand JG (1989) Structure and function of the deutocerebrum in insects. Annu Rev Entomol 34:477-501.
Homberg U, Montague RA, Hildebrand JG (1988) Anatomy of antenno-cerebral pathways in the brain of the sphinx moth Manduca sexta. Cell Tissue Res 254:255-281.
Ikeno H, Nishioka T, Hachida T, Kanzaki R, Seki Y, Ohzawa I and Usui S (2007) Development and application of CMS-based database modules for neuroinformatics. Neurocomputing 70: 2122-2128
International Silkworm Genome Consortium. (2008) The genome of a lepidopteran model insect, the silkworm Bombyx mori. Insect Biochem Mol Biol 38:1036-1045.
Iwano M, Kanzaki R (2005) Immunocytochemical identification of neuroactive substances in the antennal lobe of the male silkworm moth Bombyx mori. Zool Sci 22:199-211.
Kanzaki R, Shibuya T (1983) Olfactory neural pathway and sexual pheromone responses in the deutocerebrum of the male silkworm moth, Bombyx mori (Lepidoptera: Bombycidae). Appl Ent Zool. 18:131-133.
Kanzaki R, Shibuya T. 1986. Identification of the deutocerebral neurons responding to the sexual pheromone in the male silkworm moth brain. Zool Sci 3:409-418.
Kanzaki R, Arbas EA, Strausfeld NJ, Hildebrand JG (1989) Physiology and morphology of projection neurons in the antennal lobe of the male moth Manduca sexta. J Comp Physiol A 165:427-453.
Kanzaki R, Soo K, Seki Y, Wada S (2003) Projections to higher olfactory centers from subdivisions of the antennal lobe macroglomerular complex of the male silkmoth. Chem Senses 28:113-130.
Kazawa T, Ikeno H, Kanzaki R (2008) Development and application of a neuroinformatics environment for neuroscience and neuroethology. Neural Networks 21:1047-1055.
Kazawa T, Namiki S, Fukushima R, Terada M, Soo K, Kanzaki R (2009) Constancy and variability of glomerular organization in the antennal lobe of the silkmoth. Cell Tissue Res 336:119-136.
Kent KS, Harrow ID, Quartararo P, Hildebrand JG (1986) An accessory olfactory pathway in Lepidoptera: the labial pit organ and its central projections in Manduca sexta and certain other sphinx moths and silk moths. Cell Tissue Res 245:237-245.
Kim JH, Sung DK, Park CW, Park HH, Park C, Jeon SH, Kang PD, Kwon OY, Lee BH (2005) Brain-derived neurotrophic factor promotes neurite growth and survival of antennal lobe neurons in brain from the silk moth, Bombyx mori in vitro. Zoolog Sci 22:333-342.
Minor AV, Kaissling KE (2003) Cell responses to single pheromone molecules may reflect the activation kinetics of olfactory receptor molecules. J Comp Physiol A 189:221-230.
Mita K, Kasahara M, Sasaki S, Nagayasu Y, Yamada T, Kanamori H, Namiki N, Kitagawa M, Yamashita H, Yasukochi Y (2004) The genome sequence of silkworm, Bombyx mori. DNA Res 11:27-35.
Nakagawa T, Sakurai T, Nishioka T, Touhara K (2005) Insect sex-pheromone signals mediated by specific combinations of olfactory receptors. Science 307:1638-1642.
Namiki S, Haupt SS, Kazawa T, Takashima A, Ikeno H, Kanzaki R (2009) Reconstruction of virtual neural circuits in an insect brain. Frontiers in Neuroscience, 3:206-213.
Namiki S, Iwabuchi S, Kanzaki R (2008) Representation of a mixture of pheromone and host plant odor by antennal lobe projection neurons of the silkmoth Bombyx mori. J Comp Physiol A 194:501-515.
Namiki S, Kanzaki R (2008) Reconstructing the population activity of olfactory output neurons that innervate identifiable processing units. Front Neural Circuits 2:1.
Okada K, Kanzaki R (2004) Spatio-temporal modulation by serotonin in the first olfactory center of the male silkmoth by revealed by voltage and Ca2+ imaging. 14th International Symposium on Olfaction and Taste / 38th Japanese Association for Taste and Smell (Kyoto International Conference Hall, Kyoto, Japan, July 5-9).
Pophof B (2002) Octopamine enhances moth olfactory response to pheromones, but not those to general odorants. J Comp Physiol A 188:659-662.
Redkozubov A. (2000) Elementary receptor currents elicited by a single pheromone molecule exhibit quantal composition. Pflugers Arch 440:896-901.
Reisenman CE, Christensen TA, Francke W, Hildebrand JG (2004) Enantioselectivity of projection neurons innerating identified olfactory glomeruli. J Neurosci 24:2602-2611.
Rospars JP, Hildebrand JG (2000) Sexually dimorphic and isomorphic glomeruli in the antennal lobes of the sphinx moth Manduca sexta. Chem Senses 25:119-129.
Sakurai T, Nakagawa T, Mitsuno H, Mori H, Endo Y, Tanoue S, Yasukochi Y, Touhara K, Nishioka T (2004) Identification and functional characterization of a sex pheromone receptor in the silkmoth Bombyx mori. Proc Natl Acad Sci USA 101:16653-16658.
Seki Y, Aonuma H, Kanzaki R (2005) Pheromone processing center in the protocerebrum of Bombyx mori revealed by NO-induced anti-cGMP immunocytochemistry. J Comp Neurol 481:340-351.
Seki Y and Kanzaki R (2008) Comprehensive morphological identification and GABA immunocytochemistry of antennal lobe local interneurons in Bombyx mori. J Comp Neurol 506: 93-107.
Tabuchi M, Sakurai T, Mitsuno H, Minegishi R, Haupt SS, Shiotsuki T, Uchino K, Sezutsu H, Tamura T (2009) Millisecond photoactivation of Bombyxkol receptor neurons expressing channelrhodopsin-2 triggers pheromone searching behavior in male silkmoths. Chem Senses 34:A50-A51.
Tanaka K, Uda Y, Ono Y, Nakagawa T, Suwa M, Yamaoka R, Touhara K (2009) Highly selective tuning of a silkworm olfactory receptor to a key mulberry leaf volatile. Curr Biol 19:881-890.
Tanoue S, Sumida S, Suetsugu T, Endo Y, Nishioka T (2001) Identification of a receptor type gyanylyl cyclase in the antennal lobe and antennal sensory neurons of silkmoth, Bombyx mori. Insect Biochem Mol Biol 31:971-979.
Wada S and Kanzaki R (2005) Neural control mechanisms of the pheromone-triggered mating dance in male silkmoths revealed by double-labeling of descending interneurons and the motor neuron. J Comp Neurol 484: 168-182.
Wanner KW, Anderson AR, Trowell SC, Theilmann DA, Robertson HM, Newcomb RD (2007) Female-specific odorant receptors expressed in the adult antennae of the silkworm, Bombyx mori. Insect Mol Biol 16:107-109.
Xia Q, Zhou Z, Lu C, Cheng D, Dai F, Li B, Zhao P, Zha X, Cheng T, Chai C et al (2004) A draft sequence for the genome of the domesticated silkworm (Bombyx mori). Science 306:1937–1940.
Yamagata T*, Sakurai T*, Uchino K, Sezutsu H, Tamura T and Kanzaki R (2008) GFP labeling of neurosecretory cells with the GAL4/UAS system in the silkmoth brain enables selective intracellular staining of neurons. Zool Sci 25: 509-516.
山岡亮平.1999.「なぜカイコは桑しか食べないのか?」,化学と教育 47:458-462