昆虫の脳神経系の研究は,「少数,同定」という特徴を活かして,単一ニューロン(要素)レベルから脳システムを理解しようとする方法論がとられてきた.さらに最近では,電気生理学的計測法に加え,分子遺伝学的手法,イメージング手法,そして構成論的手法(たとえば,シミュレーションやロボティクスによる統合・評価手法)などが確立され,昆虫脳の全ニューロンの構造,機能を網羅的に分析しつつ,統合評価することができるようになってきた.ここでは,昆虫の脳を構成するニューロンの構造や機能の研究法について紹介する.
■細胞内計測と染色法
■イメージング
■遺伝子工学的手法
■工学的手法
■細胞内計測と染色法
まず,単一ニューロンの形態や機能の分析法から紹介する.昆虫脳
(図1A)では,ニューロンの細胞体はクラスターを形成し,脳表面に分布する.したがって,脳を頭部より完全に摘出し,生理食塩水で満たしたスライドグラスに固定した試料を,微分干渉装置と長作動距離対物レンズ(LUMPlanFl/IR, 倍率40倍,開口数0.80, 作動距離3.4 mm および 倍率60倍,開口数0.90, 作動距離2.0 mm)を備えた正立顕微鏡(BX51WI,Olympus)に設置し,近赤外光(波長>775 nm)を透過照明すると,個々のニューロンの細胞体を視覚化することができる
(図1B,C).したがって,近赤外光専用のCCDカメラ(C2741-79,浜松ホトニクス)で計測対象の細胞体群をとらえ,映像をモニタしながら,3Dマイクロマニピュレーター(ONU-31P,Olympus)を操作してガラス微小電極(10〜100MΩ)を目的の細胞体に刺入することができる
(図1B,C).
電極内にはあらかじめ蛍光色素を入れておき,通電により細胞内に注入して,ニューロンを染色する.蛍光色素としては
Lucifer Yellow CH,
Alexa Flour 568あるいは,
Neurobiotin(この場合,Cy-3 conjugated avidinで抗体標識する)を使用する.1つの脳標本に対して複数の異なるニューロンを同時に染色することも
(図?),また神経伝達物質の免疫組織学的染色と併用(二重染色)することにより,伝達物質の候補の特定もでき
(図1D,E),神経回路を追跡するには都合がよい.
また,電極が細胞内に刺入されたかどうかは,膜電位から判断できるとともに,実際に蛍光色素を注入する様子を,蛍光照明装置で励起することにより確認できる
(図1B, C).このような手法により,昆虫脳で情報処理に関与する多数のニューロンの構造と機能のデータベース化を行い,その情報を活用することにより,カイコガのフェロモンにより解発されるプログラム行動のしくみを脳内情報経路,さらには神経回路の情報処理として分析し,理解できるようになった.
■イメージング
脳活動は多数のニューロンの発火により生じる.多数のニューロンの時空間的な活動を同時にみるためにはどうすればよいか.その答えの一つが機能性の蛍光色素を用いたイメージングである.われわれは主にカイコガの嗅覚系一次中枢である
触角葉(antennal lobe; AL)を対象に,フェロモンを含め,匂いの識別のしくみを探るため,匂い刺激により生じる触角葉の時空間活動をイメージング技術により計測している
(図.?).
神経系の生理機能計測のためのイメージングとしてもっとも普及しているのが
カルシウム感受性蛍光色素を用いたものである.これは,ニューロン内にカルシウム感受性色素を負荷して蛍光強度変化を計測するものである.この色素はカルシウムと配位結合することにより,分子の立体構造が大きく変わり蛍光強度が変化する.ニューロンの前/後シナプス活動にはカルシウム濃度変化が伴うため,細胞内にカルシウム感受性色素が存在していればこれを時空間的に観察することができる.色素を注入する方法の一つにAM法がある.AM体(アセトキシメチルエステル体)は膜透過性であり,細胞内のエステラーゼによって細胞内でAM基がとれて,本来の機能を発揮するようになるため細胞外から負荷できる.ただし,細胞内のカルシウム濃度変化とカルシウム蛍光色素の性質により時間スケールは遅く,in
vivoでは1秒程度である.われわれはカイコガ触角葉で,匂い刺激に対する応答を計測している
(図?).
最近では,後述のように遺伝子操作技術により特定のニューロンに
カルシウム感受性タンパク(たとえば
GCaMP)を発現させて計測できるようになり,カイコガのフェロモンリセプタにGCaMPを発現させ,そのイメージングも可能となっている.
一方,
膜電位感受性色素は細胞膜表面に結合し,ニューロン活動の興奮・抑制(膜電位変化)による細胞膜の物性変化により,蛍光強度が変化する.その変化幅は小さく,わずかに0.1%程度であるが,膜電位を直接みられるのが強みである.われわれは,触角神経(触角葉への入力)の電気刺激により生じる触角葉の時空間応答の計測に成功している
19)(図?).この応答は神経修飾物質の一つであるセロトニン(5HT)の効果により増大し,カイコガのフェロモン応答の感度調整が中枢で行われることがこの研究から明らかになってきた
19)(図?).
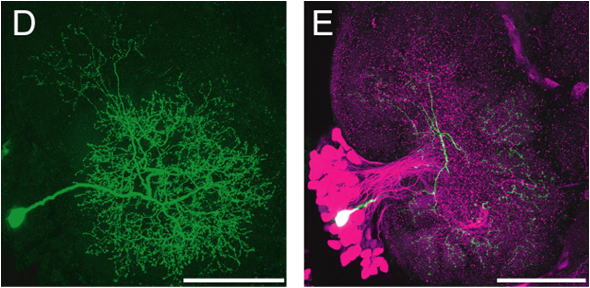
図1.カイコガの脳と脳を構成する単一神経細胞.(A) カイコガの脳の正面像.(B, C) 微分干渉装置を備えた正立顕微鏡により,(A)の脳を近赤外光(波長>775
nm)により透過照明すると,個々のニューロンの細胞体を視覚化することができる.3Dマイクロマニピュレーターを操作してガラス微小電極を目的の神経細胞の細胞体(矢頭)に刺入し,電極内の蛍光色素を注入して染色する.(D)
染色した単一の神経細胞.(E) (D)の脳標本に対して神経伝達物質の免疫組織学的染色を併用(二重染色)することにより,伝達物質の候補を特定する.ここでは,抑制性の神経伝達物質であるGABA免疫組織染色を同時に行うことによって,(D)の神経細胞がGABA抑制性神経であることがわかる.GABA抑制性神経は赤色に蛍光標識される.スケール:1mm(A),100um(B-E).
■遺伝子工学的手法
近年の大規模なDNA配列決定技術の進展にともない,生物の遺伝情報であるゲノム配列が多くの種で決定されている.カイコガにおいてもゲノムプロジェクトがほぼ完了し,遺伝子配列が網羅的に明らかにされている
10),11).このような遺伝子情報に基づいて,細胞を可視化する技術として組織中のmRNAを検出する
in situ hybridization法,タンパク質を検出する
免疫組織化学的手法,そして
トランスジェニック技術と
遺伝子プロモーターを利用した
分子遺伝学的手法があげられる.
前者2つの手法が組織の固定を必要とし「死んだ」動物でしか適用できないのに対し,分子遺伝学的手法は「生きた」動物の細胞をin vivoで可視化できるという大きな利点がある.さらに,この手法は単にニューロンの可視化にとどまらず,神経伝達の阻害による特定の神経回路の機能解析や機能遺伝子の導入によるニューロンの機能改変をin vivoで行うことを可能にし,遺伝子から行動を「みる」ために必要不可欠な技術となっている.
このような分子遺伝学的手法による脳神経系の解析はこれまで遺伝子操作技術の発達した
キイロショウジョウバエ(
Drosophila melanogaster)の独壇場であったが,2000年に田村らにより,カイコガでトランスジェニック体の作出法が確立され
12),カイコガ脳神経系の研究に分子生物学的手法を導入することができるようになった.ここではわれわれが進めているカイコガ脳神経系への分子遺伝学的手法の適用について紹介する.
カイコガでは,
トランスポゾンの一種である
piggyBacを利用したトランスジェニック体の作出法が確立されている
12).トランスジェニック体で特定のニューロンで外来遺伝子を発現させるためには,ターゲットとする細胞で発現することが知られている遺伝子のプロモーター領域を利用する
(Fig. 7A).ニューロンを可視化するためのレポーター遺伝子としては染色の操作の必要がなく,生物が生きた状態で検出できる
緑色蛍光タンパク質(GFP),
赤色蛍光タンパク質(DsRed)などの蛍光タンパク質が主に使用される.
図?に人工プロモーターである3xP3プロモーターを用いて,カイコ胚と幼虫の単眼の感覚ニューロンをDsRedで可視化した例を示した.これらのレポーター遺伝子は比較的均一に細胞質に分布するため,発現したニューロン全体の形態を可視化することができる.
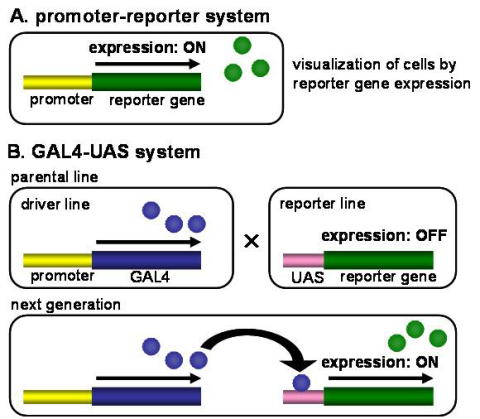
Fig. 7 Schematic diagram of reporter gene expression systems in transgenic
silkmoths. (A) In the promoter-reporter system, promoter sequence is placed
immediately upstream of reporter gene and directly activates reporter gene
expression. (B) In the GAL4-UAS system, reporter gene expression is activated
via GAL4-UAS yeast transcriptional system.
一方で,ショウジョウバエでは細胞内局在シグナル配列を付加した蛍光タンパク質を用いることで,シナプス末端などニューロンの特定の領域の可視化がなされており,カイコガでもそのようなレポーター系統の作出が待たれる.また,レポーター遺伝子にカルシウム感受性蛍光タンパク質G-CaMPを用いることで神経活動のイメージングを行うことができる.同じトランスジェニック系統内の個体は遺伝的に均一であるため,一度トランスジェニック系統を作出すれば,異なる個体で同じ細胞を標識することができる.
プロモーターによる導入遺伝子発現調節の発展型として
酵母由来転写因子GAL4とその標的配列である
UASを利用した
GAL4-UASシステムがショウジョウバエを中心に広範に使われている.このシステムでは,プロモーター下にGAL4遺伝子配列をつないだ組換え遺伝子を持つ系統とUAS下にリポーター遺伝子をつないだ組み換え遺伝子を持つ系統を別個に作出する.両者を交配して得られた次世代個体ではGAL4がUASに結合し,リポーター遺伝子が発現する
(Fig. 7B).GAL4-UASシステムの利点として,発現細胞の特異性を決定するGAL4系統と,レポーター遺伝子を発現するUAS系統が別の系統として分離されていることがあげられる.すなわち,UAS下流に異なる遺伝子をつないだ系統を交配に用いることで,1回の交配実験により簡便にさまざまなレポーター遺伝子やエフェクター遺伝子を同じ細胞で再現的に発現できる.
カイコガにおいても2003年に今村らにより,GAL4-UASシステムが体組織で正常に機能することが報告された
13).そこでわれわれはまず,GAL4-UASシステムが脳神経系で正しく機能することを検証するために,2種類の神経ペプチドホルモンのプロモーター配列の下流にGAL4をもつトランスジェニック系統をそれぞれ作出した.これらの系統とUAS-GFP系統の交配で得られた次世代個体では神経ペプチド分泌細胞で特異的にGFP蛍光が観察された
(山形ら,投稿中).この結果は,遺伝子プロモーターを利用してカイコガ脳の特定のニューロンを可視化するためにGAL4-UASシステムが有用であることを示している.
そこで,このシステムを利用してフェロモン情報の触角から脳への空間的な情報入力パターンを調べるために,フェロモン主成分である
ボンビコールの受容体遺伝子
BmOR114)と副成分である
ボンビカールの受容体遺伝子
BmOR315)のプロモーター領域下でGAL4を発現する系統を作出した.これまでに,これらの系統とUAS-GFP系統の交配で得られた次世代個体の解析から,触角で受容されたボンビコールとボンビカールの情報が,嗅覚系一次中枢である触角葉の異なる領域に伝達されることを見出している(櫻井ら,未発表).さらに,これらのGAL4系統をUAS-GCaMP系統と交配し,触角をフェロモンで刺激したときの触角葉のカルシウムイメージングに成功している.
このように,カイコガのフェロモン情報処理に関与するニューロン群の構造と機能の理解に分子遺伝学的手法が利用できるようになってきた.今後の課題として,毒素遺伝子などの細胞死や神経伝達を阻害する遺伝子を発現するUAS系統を作出することがあげられる.これにより,可視化したニューロンの機能を阻害し,特定の神経回路がフェロモン源定位行動に果たす役割を個体レベルで知ることができる.さらには,可視化したニューロンに機能遺伝子を導入し,積極的にニューロンの機能を改変することも可能になるだろう.たとえば,イオンチャネルや神経伝達物質受容体遺伝子の導入によりニューロンの特性を遺伝子レベルで改変することで,フェロモン源定位行動の基にある神経回路の機能を改変し,行動を人為的にデザインすることができるようになるかもしれない.